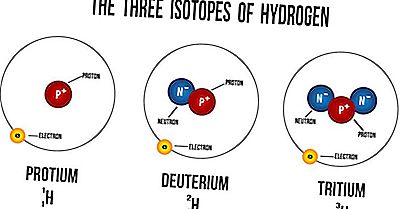
O que é um isótopo?
Os isótopos são átomos do mesmo elemento que possuem um número igual de prótons, mas diferentes números de nêutrons. Seus números atômicos são os mesmos, mas seus números de massa são diferentes. Os números de massa são sempre denotados por A, enquanto Z se refere aos números atômicos dos elementos. O número atômico simboliza o número de prótons no núcleo de um átomo e é usado para identificar a posição do elemento na tabela periódica. O número de massa de um átomo é o número de nêutrons em seu núcleo. Os isótopos dos elementos possuem diferentes propriedades físicas devido à variação em suas massas atômicas. Devido a essa diferença, tais isótopos possuem diferentes densidades, bem como pontos de fusão e ebulição. No entanto, os isótopos de um elemento têm sempre propriedades químicas muito semelhantes. A semelhança ocorre porque somente os elétrons são usados em reações químicas, não nos nêutrons ou prótons.
História dos Isótopos
O radioquímico Fredrick Soddy sugeriu pela primeira vez a existência de isótopos em 1913 após a realização de estudos que envolveram o decaimento de cadeias radioativas. Durante seus experimentos, Soddy percebeu que existiam quarenta espécies diferentes entre chumbo e urânio, ainda que a tabela periódica pudesse acomodar apenas átomos 11. Depois que testes químicos realizados para separar alguns desses elementos falharam, ele sugeriu que mais de um tipo de átomo poderia compartilhar a mesma posição na tabela periódica e denominá-los de isótopos.
Exemplos de isótopos
O cloro contém dois isótopos principais: cloro-35 e cloro-37. Para chegar a esta conclusão, os cientistas descobriram que em uma substância de cloro, as proporções de cada um desses isótopos existem em geral, e é por isso que os rácios são usados para expressar a diferença em quantidade. Essas proporções são úteis no cálculo de porcentagens relativas e massas atômicas relativas. Outros exemplos de isótopos incluem carbono (carbono-12 e isótopos de carbono-14), oxigênio (oxigênio-16 e oxigênio-18) e fósforo (fósforo-31 é o isótopo primário, embora também existam quantidades específicas de fósforo-32). Os isótopos desses compostos são considerados estáveis e a maioria deles tem apenas dois isótopos. No entanto, existem alguns elementos que têm apenas um isótopo, e estes incluem flúor, berílio, arsênico, ítrio, ouro, alumínio, iodo, manganês, sódio e nióbio.
Purificação de Isótopos
Existem três áreas principais onde os isótopos são aplicados. A primeira é a separação dos isótopos. A separação facilita a maximização das propriedades dos átomos, conforme necessário. Na separação de elementos mais leves, como deutério e oxigênio, existe a aplicação do método de difusão gasosa. A separação de elementos pesados como o urânio e o plutônio ocorre por espectrometria de massa.
Aplicação de isótopos
A primeira aplicação dos isótopos é a sua utilização pelos arqueólogos na datação por carbono. Isótopos são dois tipos: isótopos estáveis e radioativos. Os isótopos estáveis contêm uma combinação igual de prótons e nêutrons e, como tal, não sofrem decomposição. Por outro lado, os isótopos radioativos têm núcleos instáveis e, portanto, sofrem decomposição. O decaimento radioativo pode demorar tanto quanto 5,730 anos, como o elemento de carbono. Arqueólogos usam esse componente de isótopos para determinar a idade de um objeto encontrado em escavações arqueológicas.








